Résultat
stratégique : Des produits de santé et des aliments plus sûrs pour les Canadiens
Résultats pertinents dans « Le rendement du Canada » : Des Canadiens en meilleure santé ayant accès à des services de santé de qualité
Objectif : Santé Canada contribue à maintenir et à améliorer l'état de santé des Canadiens en évaluant et en surveillant l'innocuité, la qualité et l'efficacité des médicaments, des vaccins, des matériels médicaux, des produits de santé naturels
et des autres produits thérapeutiques ainsi que la salubrité et la qualité des aliments à la disposition des Canadiens. Notre mandat législatif englobe aussi l'évaluation et la surveillance de l'innocuité, de la qualité et de l'efficacité des médicaments vétérinaires vendus au Canada ainsi que de la salubrité des aliments provenant d'animaux traités avec ces médicaments. Santé Canada fournit aussi des renseignements en matière de santé faisant autorité et cherche à promouvoir des conditions qui permettent
aux Canadiens de faire des choix sains et de prendre des décisions éclairées relativement aux produits de santé, aux aliments et à la nutrition.
[9]
9.
http://www.hc-sc.gc.ca/hpfb-dgpsa/
Renseignements financiers
|
Millions de dollars
|
Dépenses prévues en
2004-2005
|
Total des autorisations en
2004-2005
|
Dépenses réelles en
2004-2005
|
|
Dépenses brutes
|
224,1
|
238,8
|
218,7
|
|
Revenus prévus
|
(40,7)
|
(40,7)
|
(34,7)
|
|
Dépenses nettes
|
183,4
|
198,1
|
184,0*
|
|
ETP
|
1 953
|
1 971
|
1 849
|
*Représente 42,1 % des dépenses réelles du secteur d'activités Promotion et protection de la santé (en excluant l'Agence de santé publique du Canada).
Les écarts entre les dépenses prévues et les autorisations sont principalement attribuables aux éléments suivants :
-
financement supplémentaire pour l'ESB dans les secteurs de l'évaluation des risques et de la recherche ciblée
-
financement supplémentaire pour la Stratégie d'accès aux produits thérapeutiques (SAPT)
-
transferts à d'autres ministères pour la Stratégie canadienne en matière de biotechnologie
Les dépenses réelles sont inférieures de 14 millions de dollars aux crédits autorisés, principalement pour les raisons suivantes :
-
report de fonds de la SAPT pour répondre aux besoins des années ultérieures comme l'Initiative sur l'innocuité des produits thérapeutiques
-
rajustements de fin d'exercice et dépenses moins élevées qu'elles n'avaient été prévues dans divers programmes
Résultats intermédiaires
-
Résultats positifs en matière de santé grâce à des produits de santé sûrs et efficaces et à des aliments salubres et nutritifs
-
Contribution des scientifiques, des professionnels de la santé et de l'industrie du Canada à l'innovation en matière de santé et de santé publique
-
Confiance du public dans l'innocuité des
produits de santé, la salubrité des aliments et le système de réglementation
Résultats immédiats
-
Accroissement de la rapidité, de la transparence et de la prévisibilité du processus de réglementation
-
Collaboration internationale et coopération nationale accrues
-
Meilleur partage de l'information avec les principaux partenaires ou intervenants dans le domaine de la science et de l'innovation en santé
-
Sensibilisation accrue des Canadiens aux
produits de santé, aux aliments et à la nutrition et prise de décisions plus éclairées par les Canadiens
-
Participation accrue du public à l'élaboration et à la mise en oeuvre des politiques, des décisions réglementaires et des programmes relatifs aux produits de santé, aux aliments et à la nutrition
-
Conformité de l'industrie aux règlements et aux normes de sécurité
Priorités
-
Transformer notre efficience, notre efficacité et notre capacité
d'intervention à titre d'organe de réglementation
-
Fournir de l'information faisant autorité pour aider les Canadiens à faire des choix judicieux et à prendre des décisions éclairées
-
Accroître la sensibilité aux questions de santé publique et la vigilance en matière de sécurité et d'efficacité thérapeutique dans le monde réel
-
Améliorer la transparence, l'ouverture et la reddition de comptes afin de renforcer la confiance du public et les relations avec les intervenants
Liens entre les programmes, les ressources et les résultats
|
Programmes
|
Dépenses réelles (en M $)
|
Lien avec les résultats
|
|
Évaluation réglementaire avant la mise en marché et amélioration du processus
|
86,7
|
Effectuer un examen réglementaire avant
la mise en marché des médicaments pour usage humain ou vétérinaire, des produits biologiques, des thérapies génétiques, des matériels médicaux, des produits de santé naturels et des aliments. Grâce à la Stratégie d'accès aux produits thérapeutiques, continuer d'améliorer la rapidité, la transparence et la prévisibilité de ses examens avant la mise en marché des produits thérapeutiques pour usage humain en les comparant aux pratiques internationales de pointe, tout en maintenant les normes élevées
d'innocuité et de salubrité de Santé Canada.
|
|
Information, éducation et sensibilisation concernant les produits de santé, les aliments et la nutrition
|
5,9
|
Favoriser les décisions éclairées et les choix judicieux chez les consommateurs, les patients et les professionnels de la santé grâce à une vaste gamme d'activités liées aux produits de santé et aux aliments, y compris par des politiques et des normes de nutrition comme le
Guide alimentaire canadien pour
manger sainement
.
|
|
Surveillance de l'innocuité et de l'efficacité thérapeutique et gestion des risques
|
82,9
|
Améliorer la surveillance après la mise en marché de l'innocuité et de l'efficacité thérapeutique en faisant preuve d'une plus grande vigilance à l'égard des questions liées à l'innocuité et à l'efficacité des produits thérapeutiques après leur commercialisation et en recueillant de l'information sur les réactions indésirables aux produits de santé au
Canada. Cerner et évaluer les risques pour la santé et la sécurité et signaler tout problème au public et exécuter des activités de vérification de la conformité pour s'assurer que les produits de santé disponibles au Canada satisfont aux normes canadiennes et aux normes internationales d'innocuité, de qualité et d'efficacité.
|
|
Transparence, reddition de comptes au public et relations avec les intervenants
|
8,5
|
Renforcer la transparence, l'ouverture et la
responsabilisation grâce à l'augmentation du nombre d'activités visant à assurer la participation du public et à l'amélioration des plans et rapports annuels.
|
Résumé
Les Canadiens se déclarent toujours très satisfaits de l'innocuité des produits de santé et de la salubrité des aliments qu'ils consomment. En qualité d'organisme fédéral responsable de la réglementation des produits de santé et des aliments, Santé Canada évalue et surveille l'innocuité, la
qualité et l'efficacité de milliers de médicaments (pour usage humain et vétérinaire), de vaccins, de sang et de produits du sang, de thérapies biologiques et génétiques, de matériels médicaux et de produits de santé naturels, ainsi que la salubrité des aliments que les Canadiens consomment. L'un des éléments clés de nos fonctions consiste à fournir des renseignements utiles sur les risques et les avantages liés aux produits de santé et aux aliments afin que les Canadiens soient en mesure de prendre des
décisions éclairées concernant leur santé et leur bien-être.
Nos responsabilités continues en matière de réglementation portent sur l'ensemble du cycle de vie des produits de santé et des aliments - des essais cliniques à la surveillance, en passant par la conformité et l'application des règlements. Nos fonctions ont une portée considérable et visent au-delà de 22 000 médicaments pour usage humain et 40 000 matériels médicaux accessibles sur le marché canadien. De plus, nous faisons face à
des défis liés à la rapidité du progrès technologique et des percées scientifiques. Nous relevons ces défis en faisant appel à des principes scientifiques objectifs et à une gestion efficace des risques pour prendre des décisions fondées sur des données probantes, afin de favoriser l'innocuité des produits de santé et la salubrité des aliments offerts aux Canadiens.
Notre Ministère a poursuivi la mise en oeuvre de la Stratégie d'accès aux produits thérapeutiques (SAPT), qui a entraîné une amélioration
considérable de la rapidité et de l'efficience de notre processus d'examen des produits thérapeutiques.
Nous avons également poursuivi l'élaboration d'un cadre de coopération internationale en matière de réglementation, afin d'établir des liens plus solides et une collaboration plus étroite dans ce milieu touché par une mondialisation croissante. Cette stratégie tournée vers l'avenir accroîtra l'efficience et l'efficacité des activités internationales qui nous permettent de suivre le rythme de la
mondialisation, des tendances en matière de santé publique et du changement technologique. Dès lors, cette amélioration éclairera et renforcera nos mesures réglementaires nationales.
Le cadre national de politique alimentaire (CNPA) constitue une autre initiative importante que nous avons mise en oeuvre de concert avec Agriculture et Agroalimentaire Canada (AAC), l'Agence canadienne d'inspection des aliments (ACIA) et d'autres intervenants. Cette initiative fédérale-provinciale-territoriale visait à
assurer une collaboration et une coopération intergouvernementales plus efficaces en ce qui concerne les questions d'alimentation stratégiques et prioritaires. Elle facilitera également la mise en oeuvre au niveau des programmes dans l'ensemble des secteurs de compétence et des portefeuilles ayant des responsabilités liées aux aliments. En fin de compte, cette initiative devrait nous permettre d'améliorer la gestion du système alimentaire du Canada, de renforcer la salubrité des aliments, d'accroître la
contribution du système canadien d'alimentation à de saines habitudes alimentaires et d'appuyer un secteur de l'alimentation novateur, durable et prospère, de même que la protection et la promotion des intérêts des consommateurs.
Les Canadiens, les professionnels de la santé et les éducateurs sont de plus en plus avisés et compétents en gestion de la santé et cherchent à être plus informés pour prendre des décisions et faire des choix sains. Il est donc essentiel que les recommandations nutritionnelles de
Santé Canada soient à jour et qu'elles tiennent compte des connaissances scientifiques courantes et de l'évolution du milieu de l'alimentation. La révision du
Guide alimentaire canadien pour manger sainement
, qui s'est poursuivie au cours de l'exercice 2004-2005, permettra au Ministère de continuer de fournir des renseignements favorisant l'adoption d'habitudes alimentaires qui comblent les besoins nutritionnels, contribuent à la santé et réduisent les risques de maladies chroniques liées à la
nutrition. L'obésité, plus prévalente au Canada depuis les 25 dernières années, est un important facteur qui rend les personnes plus susceptibles de développer des maladies telles que le diabète de type 2.
[10]
Prévalence du diabète, selon la catégorie d'IMC et le sexe, population à domicile agée de 18 ans et plus, Canada, territoires non compris, 2004 (%)
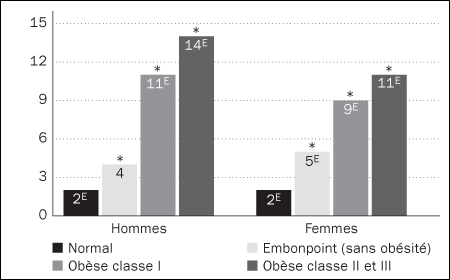
Source des données : Enquête de 2004 sur la santé dans les collectivités canadiennes : Nutrition.
* Valeur significativement différente de l'estimation pour la catégorie « Normal » (p < 0,05)
E Coefficient de variation compris entre 16.6% et 33.3% (interpréter avec prudence)
10.
http://www.statcan.ca/english/research/82-620-MIE/82-620-MIE2005001.htm
Les Canadiens veulent que leurs gouvernements soient attentifs, ouverts, transparents et responsables. À cette fin, nous avons élaboré et mis en oeuvre des mécanismes efficaces pour nous assurer que les Canadiens et les intervenants sont correctement informés, que leurs points de vue sont entendus et que les gouvernements sont tenus responsables de la manière dont l'expertise et
l'avis du public sont utilisés.
En 2004-2005, ces initiatives et d'autres mesures faisaient collectivement partie de quatre priorités axées sur l'innocuité des produits de santé et la salubrité des aliments à l'intention des Canadiens.
Priorité 1 : En cours
Transformer notre efficience, notre efficacité et notre capacité d'intervention à titre d'organe de réglementation
Le Canada, comme les autres principaux pays
industrialisés, est confronté à des défis et des possibilités liés à l'évolution rapide de la technologie et des sciences. Les Canadiens s'attendent à avoir accès à des produits thérapeutiques novateurs et à des aliments salubres au moment opportun. Pour ces raisons, d'énormes pressions sont exercées pour que notre système de réglementation et nos ressources scientifiques tiennent le rythme afin que les Canadiens aient confiance dans nos normes élevées de salubrité et que l'industrie bénéficie d'un milieu de
réglementation comparable à celui des pays étrangers. L'utilisation efficace des ressources et des connaissances d'autres organismes et gouvernements favorise des décisions plus éclairées, uniformes et opportunes. Elle peut également entraîner l'élaboration de normes et de pratiques conjointes, promouvoir l'innovation technologique et en fin de compte permettre un meilleur accès des Canadiens aux produits et méthodes thérapeutiques les plus récents. Au cours de l'exercice 2004-2005, nous avons réalisé de nets progrès
en matière d'efficience, d'efficacité et de réceptivité réglementaires, comme l'atteste notre rendement au regard de nos engagements.
|
Engagements définis dans le RPP de 2004-2005
|
Rapport sur les résultats
|
|
Atteindre 90 % des objectifs de rendement visant l'examen des présentations de nouveaux médicaments en 2005-2006 pour les produits pharmaceutiques et en
2006-2007 pour les produits biologiques et les thérapies génétiques, y compris l'élimination des arriérés de présentations.
1
Santé Canada atteindra cet objectif sans compromettre la sécurité publique en restructurant ses processus d'examen, en augmentant sa capacité scientifique et en appliquant la gestion de projet et d'autres systèmes qualité aux processus d'examen. Le Ministère appliquera également ces systèmes aux
présentations de médicaments génériques et à usage vétérinaire et aux nouveaux aliments
|
De nouveaux investissements, par le biais de la SAPT, ont permis de réduire de 89 % l'arriéré de présentations de drogues nouvelles d'avril 2003 à mars 2005. Dans le secteur des produits biologiques, l'arriéré des présentations de drogues nouvelles a diminué de 7 % au cours de la même période. En 2004, 25 % des décisions réglementaires touchant des présentations de drogues nouvelles ont été prises
dans les délais prescrits, soit près du double du pourcentage de 2003 - 13 %.
http://www.hc-sc.gc.ca/ahc-asc/branch-dirgen/hpfb-dgpsa/index_f.html

Nous continuons à mettre en place des outils de gestion et d'amélioration pour atteindre les objectifs de rendement.
De plus, nous avons dépassé notre objectif de
rendement de 90 % pour l'examen des présentations de médicaments à usage vétérinaire datant de plus de 18 mois au 1
er
avril 2004, conformément à notre engagement pris dans le RPP de 2004 à appliquer des moyens et des méthodes pour les présentations non financées par la SAPT.
Nous élaborons actuellement des systèmes de qualité pour l'examen des aliments nouveaux. Ce faisant, nous améliorons la transparence en affichant des données sur Internet et en faisant participer des experts
externes aux décisions touchant les aliments.
|
|
Mettre en oeuvre des stratégies qui appuient les engagements pris préalablement auprès de l'industrie, des groupes de patients ou de consommateurs et d'autres intervenants du développement des médicaments
|
Les mesures prises comportaient l'augmentation de la représentation aux réunions avec les intervenants de l'industrie portant sur les demandes d'essais cliniques préalables, grâce à l'intégration d'examinateurs scientifiques
des secteurs clinique, chimique et manufacturier.
|
|
Mettre en oeuvre de bonnes pratiques d'orientation en vue d'aider l'industrie à améliorer la qualité des présentations et de bonnes pratiques d'examen pour assurer des examens de qualité élevée
|
Au chapitre des bonnes pratiques d'examen, nous avons harmonisé les nouveaux formulaires d'examen et les procédures opérationnelles normalisées afin de pouvoir recevoir les présentations dans le format Common Technical
Document (CTD) de la Conférence internationale sur l'harmonisation. Plusieurs pays, dont le Canada, les États-Unis, les pays d'Europe, le Japon et l'Australie, utilisent ce format. L'utilisation d'un format international commun facilite le dépôt simultané des présentations dans divers pays, ce qui contribue à réduire le fardeau réglementaire imposé aux fabricants.
http://www.hc-sc.gc.ca/dhp-mps/brgtherap/applic-
demande/guides/qualit/prod/index_f.html
Nous élaborons un cadre de bonnes pratiques d'orientation, afin d'appuyer le dépôt de présentations de qualité supérieure par l'industrie. Un processus et des procédures opérationnelles normalisées ont été définis pour la rédaction des documents d'orientation et ils font actuellement l'objet d'un examen.
Nous avons effectué une évaluation des besoins en orientation au cours de l'été 2004 par le biais de consultations internes et externes.
http://www.hc-sc.gc.ca/dhp-mps/prodpharma/activit/consultation/
ggp_grp_notice_bpld_bpe_avis_f.html
|
|
Continuer d'appuyer la recherche scientifique dans divers domaines liés aux nouvelles technologies, comme les thérapies génétiques et les systèmes de délivrance des nouveaux médicaments, en vue de mieux guider l'industrie relativement aux exigences
réglementaires et d'étayer l'examen des pratiques
|
Nous avons mené des recherches sur les thérapies génétiques visant à réduire les caillots de sang et sur les systèmes de délivrance de nouveaux médicaments. Les documents scientifiques faisant état des résultats de nos recherches ont été publiés dans des publications scientifiques internationales examinées par les pairs, comme
Biochem Cell Biology
et
Biochemical and Biophysical Research Communications
.
|
|
Élaborer un cadre de gérance de la biotechnologie afin de faciliter la mise en place responsable des nouvelles découvertes au moyen de mécanismes de réglementation nouveaux et appropriés et évaluer l'établissement d'un code de pratique applicable à tous les intervenants qui entreprennent des activités de politique, de réglementation et de recherche
|
Le Ministère a reçu 360 000 $ du Fonds de la Stratégie canadienne de la biotechnologie pour appuyer l'élaboration d'un cadre et
mener des recherches relativement à un code de pratique canadien en matière de biotechnologie. En 2004-2005, nous avons effectué une consultation fédérale sur une ébauche de cadre.
Nous avons proposé un code de pratique pour la mise en oeuvre du cadre visant à appuyer les activités de politique, de réglementation et de recherche. Un atelier gouvernemental initial a eu lieu dans le but d'examiner la portée et l'orientation du code. L'initiative devrait prendre fin d'ici 2007.
|
|
Mettre en oeuvre un nouveau protocole d'entente (PE) avec la
U.S. Food and Drug Administration
en vue d'appuyer un processus plus efficace d'évaluation des produits thérapeutiques qui permet au public d'accéder plus rapidement aux nouvelles thérapies importantes et de détecter plus rapidement les risques associés aux produits de santé commercialisés
|
Le Ministère a retenu plusieurs priorités mentionnées dans le plan de mise en oeuvre du PE :
-
effectuer une
comparaison rétrospective entre le Canada et les É.-U. en ce qui concerne l'examen des présentations de médicaments;
-
exécuter un projet pilote sur le partage des dossiers d'examen;
-
se tenir mutuellement au courant des essais cliniques réalisés dans chaque pays;
-
partager les renseignements touchant l'innocuité des médicaments, y compris les mises en garde publiques sur les anti-inflammatoires non stéroïdiens (AINS) inhibiteurs sélectifs de la COX-2; ces médicaments sont utilisés pour
contrôler la douleur et l'inflammation associées aux maladies rhumatismales et à d'autres affections moins graves.
|
|
Exécuter, avec la
Therapeutic Goods Administration (TGA)
australienne, un projet pilote sur l'examen conjoint des présentations de produits qui permet au Ministère d'échanger l'information tout en maintenant ses normes élevées d'efficacité, de qualité et de sécurité
|
En avril 2004, nous avons signé un PE avec la TGA sur le partage de
renseignements généraux en vue de faciliter l'échange de logiciels conçus pour réduire le nombre d'erreurs médicales et d'engager des discussions sur l'élaboration d'un processus conjoint d'examen des présentations de produits. Le projet pourrait servir de modèle pour une collaboration entre les deux organisations relativement à la réglementation des médicaments à risque élevé.
En outre, nous avons signé un PE élargi avec Food Standards Australia/New Zealand afin de collaborer sur des questions d'intérêt
mutuel, y compris l'évaluation des aliments nouveaux, l'évaluation quantitative du risque microbien et les allégations thérapeutiques concernant les aliments et l'enrichissement des aliments.
|
|
Élaborer une stratégie internationale de coopération en matière de réglementation afin d'établir une approche à long terme de la collaboration internationale dans des domaines comme les aliments, la nutrition et les produits de santé
|
Nous avons consulté d'autres ministères et
organismes (p. ex. le ministère des Affaires étrangères et du Commerce international et le Bureau du Conseil privé) et d'autres intervenants en politiques (p. ex. le Policy Research Institute) dans l'élaboration d'un cadre qui sera publié à l'automne 2005. Cet outil nous permettra de mener des activités internationales selon une approche plus stratégique et davantage axée sur les résultats à l'appui de la SAPT.
|
|
Mettre en oeuvre un système de gestion de l'information de laboratoire
(SGIL) pour appuyer les activités liées aux produits biologiques et aux thérapies génétiques afin de faire accréditer nos laboratoires conformément aux normes de qualité internationales
|
Nous avons effectué des essais en laboratoire aux fins d'établissement d'un SGIL et inventorié les données relatives aux produits biologiques pouvant présenter un risque élevé.
|
|
Continuer de travailler avec le Japon, l'Union européenne et les États-Unis afin de réduire les essais en
double sur les nouveaux médicaments, entre autres collaborer avec le
National Institute for Biological Standards and Control (NIBSC)
du Royaume-Uni en vue d'améliorer l'échange d'information sur la recherche et sur les méthodes d'essai
|
Afin de réduire le double emploi, nous avons continué de participer à des groupes d'experts de la CIH (Conférence internationale sur l'harmonisation), particulièrement en ce qui a trait à la qualité des produits biologiques pour lesquelles
d'importantes lignes directrices seront bientôt affichées sur notre site Internet. Nous avons également siégé dans des groupes de travail du Ministère sur la CIH, entre autres dans le groupe traitant de l'« après-commercialisation » et dans un nouveau groupe. Ces travaux auront une incidence directe sur les bases de données relatives aux médicaments, sur l'échange de renseignements touchant les médicaments et sur l'innocuité des médicaments.
Nous avons engagé des discussions avec le NIBSC au sujet d'un
PE prévoyant le transfert de certaines techniques et méthodes d'essai pour les nouveaux médicaments. Toutefois, le PE n'a pu être mis au point, en raison de divers facteurs dont la restructuration du NIBSC et certaines priorités comme l'examen par les pairs à Santé Canada. Nous nous efforcerons de le mettre au point d'ici la fin de 2005-2006.
|
|
Mettre en oeuvre un système d'examen électronique pour moderniser notre approche à l'égard des présentations de produits de santé et
améliorer l'accessibilité de l'information durant le processus d'examen et tout au long du cycle de vie des produits
|
Le projet d'examen électronique est une initiative pluriannuelle qui a pour but d'établir un système électronique entièrement automatisé afin de faciliter la présentation et l'examen des médicaments et des produits thérapeutiques et de nous maintenir au niveau des principaux organismes de réglementation, de la Conférence internationale sur l'harmonisation (CIH), de l'industrie
pharmaceutique et des associations de services de santé. Au cours de l'exercice 2004-2005, nous avons déployé le système de suivi et commencé à mettre à l'essai le Système de gestion de l'information sur les dossiers et les documents.
De plus, nous avons poursuivi l'élaboration du nouveau système de distribution de médicaments vétérinaires d'urgence. Environ 15 000 dossiers, dont certains dataient de 1980, ont été transférés avec succès du système actuel au nouveau système.
|
|
Élaborer un nouveau cadre de réglementation afin de mettre en place les normes les plus rigoureuses de la CIH pour les pratiques de fabrication de médicaments, afin de renforcer la surveillance réglementaire de la qualité des ingrédients pharmaceutiques actifs que contiennent les médicaments utilisés par les Canadiens
|
Dans le cadre de notre engagement soutenu à élaborer, à adopter et à mettre en oeuvre des normes techniques internationales pour la création, l'homologation et le
contrôle des produits pharmaceutiques, nous avons continué de participer activement aux travaux de la CIH. En outre, nous avons publié un certain nombre de documents d'orientation, aux fins de consultations de l'industrie en 2004-2005.
http://www.hc-sc.gc.ca/dhp-mps/prodpharma/index_f.html
|
|
Commencer à mettre en oeuvre le
Règlement sur les produits de santé naturels
(PSN)
présenté
en janvier 2004
|
Nous avons consacré plus de 10 millions de dollars à la mise en oeuvre d'un cadre devant permettre aux Canadiens d'avoir accès à des PSN sûrs, efficaces et de haute qualité, tout en protégeant la liberté de choix et la diversité philosophique et culturelle. Grâce aux renseignements supplémentaires inscrits sur les étiquettes des PSN, les consommateurs seront davantage en mesure de prendre des décisions éclairées. De plus, le fait que les produits soient assujettis à
un examen réglementaire accroîtra la confiance des consommateurs dans l'innocuité et l'efficacité des PSN et les convaincra que les allégations relatives à la santé sont fondées sur des données probantes.
http://www.hc-sc.gc.ca/dhp-mps/prodnatur/index_f.html
|
|
Mettre en oeuvre une nouvelle ligne directrice qui établira les attentes réglementaires pour l'inclusion d'enfants dans les essais
cliniques sur les produits thérapeutiques
|
Le nombre de médicaments étiquetés pour un usage pédiatrique est limité. Le Ministère élabore donc de nouvelles lignes directrices afin d'inciter les fabricants à joindre à leurs présentations des renseignements sur la posologie pédiatrique, lorsque ce type d'étiquetage existe dans d'autres pays. En 2004-2005, nous avons commencé à recevoir des données d'étiquetage pédiatriques. Cette initiative permettra d'accroître la sécurité et l'efficacité grâce à
un étiquetage donnant plus d'information sur l'utilisation du médicament auprès des enfants.
De plus, des projets de modification au Règlement sur les aliments et drogues ont été publiés dans la Partie I de la
Gazette du Canada
. Les modifications proposées contiennent une disposition qui accorde une prolongation de la période de protection des données aux fabricants qui effectuent des études cliniques pédiatriques ou qui peuvent fournir des données provenant d'études pédiatriques menées
ailleurs par eux-mêmes.
|
Priorité 2 : En cours
Donner des informations faisant autorité pour que les Canadiens et les Canadiennes fassent des choix sains et prennent des décisions éclairées
Les Canadiens continuent de rechercher activement des renseignements fiables et fondés sur des données probantes, afin de faire des choix sains en matière de santé. L'information nutritionnelle peut contribuer de manière positive à la protection et à
la promotion de la santé. En conséquence, en 2004-2005, nous avons accru nos efforts visant à fournir des renseignements fondés et à jour sur les aliments, la nutrition et les produits de santé, notamment en distribuant deux millions d'exemplaires du
Guide alimentaire canadien pour manger sainement
(GACMS). La page Web du GACMS a enregistré une augmentation du nombre de visites de 15 p. 100, devenant la page la plus consultée du site Internet de Santé Canada.
[11]
11.
http://www.hc-sc.gc.ca/fn-an/food-guide-aliment/index_f.html
Les Canadiens comptent parmi les plus grands consommateurs d'acides gras trans au monde. Or, selon les données scientifiques, les gras trans accroissent le risque de maladie du coeur. Afin d'aider le public à réduire sa consommation de gras trans, nous avons annoncé l'étiquetage obligatoire des gras trans contenus
dans les produits alimentaires à compter du 1
er
janvier 2003 et sommes ainsi devenus le premier pays à prendre ce type de mesure. Au cours de l'exercice 2004-2005, nous avons maintenu notre engagement à mettre en place un nouveau règlement sur l'étiquetage nutritionnel exigeant que les gras trans figurent sur les étiquettes de la plupart des aliments préemballés, d'ici le 12 décembre 2005. Des tableaux de valeur nutritive ont déjà commencé à apparaître sur les étiquettes de produits
alimentaires et ils seront obligatoires à compter de décembre 2005. De plus, en 2004-2005, nous avons consacré 300 000 $ à l'établissement d'un groupe d'étude multipartite chargé d'examiner et de recommander des moyens de réduire sensiblement la quantité de gras trans dans l'alimentation des Canadiens et de faciliter des choix alimentaires sains.
[12]
12.
http://www.hc-sc.gc.ca/fn-an/nutrition/gras-trans-fats/index_f.html
Plus de 70 % des Canadiens considèrent, compte tenu de ces initiatives et d'autres efforts, que le Ministère a accompli un travail allant de satisfaisant à excellent en élaborant le GACMS et 67 % jugent qu'il incite la population à adopter un mode de vie sain.
[13]
13. Rapport à Santé Canada : enquête sur le rendement annuel de 2005, The Strategic
Counsel, mars 2005
|
Engagements définis dans le RPP de 2004-2005
|
Rapport sur les résultats
|
|
Examiner les lignes directrices en matière d'alimentation, y compris le
Guide alimentaire canadien pour manger sainement
, afin de s'assurer qu'elles continuent de promouvoir des habitudes d'alimentation qui répondent aux besoins nutritifs, favorisent la santé
et réduisent les risques de maladie chronique d'origine alimentaire. L'examen permettra de s'assurer que ces lignes directrices tiennent compte des données probantes les plus récentes sur le lien entre l'alimentation et la santé et qu'elles offrent une information faisant autorité pour aider les Canadiens à faire des choix alimentaires sains
|
Nous avons effectué des recherches afin de trouver des moyens de rendre nos recommandations nutritionnelles, y compris le GACMS, plus généralement
applicables et plus attrayantes pour les Canadiens. Nous avons appliqué des modèles en matière d'alimentation pour orienter l'intégration des quantités et des types de groupes d'aliments au GACMS.
http://www.hc-sc.gc.ca/fn-an/food-guide-aliment/revision/index_f.html
Nous avons émis deux nouvelles recommandations sur l'alimentation du nourrisson et distribué aux professionnels de la santé quelque
40 000 documents d'information, sous forme de documents imprimés, de documents Web ou d'encarts dans les publications spécialisées.
http://www.hc-sc.gc.ca/hpfb-dgpsa/onpp-bppn/infant_feeding_f.html
|
|
Continuer de sensibiliser les Canadiens aux exigences d'étiquetage nutritionnel entrées en vigueur en 2003 et à la façon d'utiliser les étiquettes pour faire des choix
alimentaires sains
|
Un nouveau règlement, publié le 1er janvier 2003, a rendu l'étiquetage nutritionnel obligatoire pour la plupart des aliments. Nous avons diffusé plus de 300 000 exemplaires de la fiche détachable sur l'étiquetage nutritionnel à l'intention des consommateurs et plus de 30 000 affiches, ainsi que des ressources documentaires ciblant les Premières nations et les Inuits. De plus, nous avons rédigé une série d'articles pour les médias.
http://www.hc-sc.gc.ca/index_f.html
http://www.phac-aspc.gc.ca/guide/
|
|
Rendre accessibles au public des documents qui exposent les raisons scientifiques et axées sur le risque sur lesquelles se fondent nos décisions concernant les produits de santé, les aliments et la nutrition
|
Le sommaire des motifs de décision (SMD) expose les motifs justifiant
l'octroi d'une autorisation de mise en marché reposant sur des données scientifiques probantes et sur un examen des risques et des avantages. En mai 2004, dans le cadre d'un projet pilote, nous avons publié des renseignements sur la manière dont nous avions décidé d'autoriser la mise en marché de deux nouveaux médicaments et d'un matériel médical. En juin 2004, nous avons consulté les intervenants sur l'ensemble de l'initiative. La première étape du projet des SMD, lancée en janvier 2005, a consisté à élaborer
les SMD, à les publier et à les afficher sur le site Web.
http://www.hc-sc.gc.ca/dhp-mps/prodpharma/index_f.html
Nous avons aussi publié quatre numéros du Bulletin canadien des effets indésirables. Le Bulletin a rejoint 64 000 médecins canadiens, de même que 1 300 médecins des États-Unis et 404 médecins d'autres pays. De plus, 28 000 copies ont été postées à des pharmaciens et à
d'autres parties intéressées. Le Bulletin a été affiché sur notre site Web et transmis à 10 000 abonnés par l'intermédiaire de la liste électronique d'envoi d'information sur les produits de santé.
http://www.hc-sc.gc.ca/dhp-mps/medeff/bulletin/index_f.html
Nous avons intensifié la campagne de sensibilisation de Santé Canada en distribuant des macarons aimantés portant des messages relatifs à la
salubrité des aliments pour consommateurs potentiellement vulnérables, dont les étudiants universitaires qui vivent loin de leur famille et, dans certains cas, s'initient à la cuisine. En outre, nous avons continué de promouvoir les messages de base de la campagne de réduction des risques d'origine alimentaire « À bas les bactéries! ». Une annonce télévisée de 2002, contenant ces messages et décrivant les techniques de cuisson appropriées, a été rediffusée en 2004.
http://www.canfightbac.org/francais/indexf.shtml
|
|
À compter de 2004, améliorer les exigences des monographies de produits pour les médicaments; entre autres, ajouter une nouvelle section sur l'information aux consommateurs
|
Les travaux ont été achevés et un compte rendu diffusé dans le Rapport sur le rendement ministériel de Santé Canada pour la période se terminant le 31 mars 2004.
|
|
Mettre en place un site Internet amélioré sur la biotechnologie en 2004-2005 afin de répondre plus efficacement aux besoins des consommateurs
|
Nous avons mis au point une architecture d'information (AI) pour notre site Internet sur la biotechnologie, qui met l'accent sur le système de réglementation pour les aliments, la santé, l'environnement et les médicaments et produits de santé issus de la biotechnologie. Plus de la moitié du contenu du site a été rédigée et révisée.
|
|
Continuer d'utiliser d'autres outils de communication, par exemple des fiches de renseignements, des brochures et des expositions, pour accroître la confiance et la sensibilisation à l'égard de la biotechnologie liée à la santé
|
L'exposition sur la biotechnologie a été présentée à trois endroits, où le public cible était principalement composé de membres de l'industrie et du milieu universitaire. Nous avons distribué des fiches de renseignements et du matériel
promotionnel ayant trait à notre site Internet sur la biotechnologie.
|
|
Investir 240 000 $ au cours des trois prochaines années pour créer un réseau de recherche qui enquêtera sur l'utilisation des plantes médicinales chez les Cris afin de prévenir et peut-être de traiter le diabète de type 2
|
Nous avons consulté les Instituts de recherche en santé du Canada et l'Institut de la santé des Autochtones (ISA). Un financement a été accordé pour faciliter la participation
de l'ISA aux futurs partenariats de recherche et permettre un investissement plus important du Programme de recherche sur les produits de santé naturels (PRPSN) dans les futurs projets de recherche.
|
|
Allouer 300 000 $ sur trois ans à un réseau de recherche sur les produits de santé naturels qui regroupera des chercheurs universitaires de pointe et des praticiens de la santé naturelle
|
Le Réseau interdisciplinaire canadien de recherche sur les médecines
alternatives et complémentaires (INCAM) en est à la deuxième année d'une enveloppe financière de cinq ans. En 2004-2005, dans le cadre d'un partenariat avec les IRSC, le PRPSN a engagé 50 000 $ sous forme de contribution à un investissement pluriannuel total de 300 000 $, pour établir un réseau de recherche sur les produits de santé naturels.
http://www.cihr-irsc.gc.ca/f/16458.html
|
Priorité 3 : En cours
Augmenter notre réactivité face à la santé publique et faire preuve d'une plus grande vigilance relativement à l'efficacité thérapeutique dans le monde réel
Les Canadiens s'attendent à ce que les aliments et les produits thérapeutiques mis en vente au Canada soient sûrs. À cette fin, nous avons entrepris un certain nombre d'activités continues afin de renforcer notre capacité de surveiller et de résoudre les problèmes liés à la santé
publique, y compris ceux qui touchent les enfants. Nous avons également accru la sensibilisation à la déclaration des effets indésirables et à la communication des risques, par divers moyens, notamment des bulletins et des avis. Un vaste sondage d'opinion publique mené en décembre 2003 auprès des consommateurs et des professionnels de la santé
[14]
a continué de livrer de l'information sur les améliorations à apporter pour accroître l'efficacité des méthodes de communication de renseignements
sur la salubrité des produits de santé. Ce sondage nous a permis non seulement de faire plus pour réduire les risques et optimiser la salubrité des produits pour les Canadiens, mais également d'accroître notre capacité d'appuyer la prise de décisions éclairées en matière de santé.
14.
http://www.hc-sc.gc.ca/dhp-mps/prodpharma/index_f.html
Lorsque des rapports externes ont révélé
une concentration de produits chimiques d'ignifugation plus élevée dans le saumon d'élevage que dans le saumon sauvage, nous avons effectué des recherches pour mieux comprendre les effets toxiques de ce type de produit sur les humains selon les diverses sources d'exposition. Les données recueillies nous ont permis de déterminer que la concentration dans les aliments, plus précisément dans le poisson d'élevage, n'entraînait pas de risque inacceptable pour la santé. Nous poursuivrons nos activités de
recherche aux échelons national et international pour nous assurer que la consommation de ces produits ne présente pas de risque pour la santé.
Notre collaboration avec l'ACIA renforcera considérablement les mesures canadiennes de sécurité relatives à l'encéphalopathie spongiforme bovine (ESB); nous serons ainsi beaucoup plus en mesure de prévenir les crises, de protéger la santé des animaux et d'assurer la salubrité des aliments. Nos activités liées à l'établissement de limites maximales de résidus (LMR)
pour les résidus de médicaments vétérinaires contenus dans les aliments provenant d'animaux traités permettent de s'assurer que ces résidus ne présentent aucun risque lorsqu'ils sont ingérés par les humains tout au long de leur vie.
Les Canadiens réagissent positivement à ces initiatives et aux mesures connexes : 70 p. 100 de la population considère que le Ministère a accompli un travail allant de bon à excellent pour ce qui est d'assurer l'innocuité des produits pharmaceutiques et la
salubrité des aliments.
[15]
15. Rapport à Santé Canada : enquête sur le rendement annuel de 2005, The Strategic Counsel, mars 2005
|
Engagements définis dans le RPP de 2004-2005
|
Rapport sur les résultats
|
|
Déterminer et évaluer les risques pour la santé et la sécurité associés aux produits, alerter le
public et gérer ces risques, en partageant les responsabilités avec l'industrie, les intervenants et les Canadiens
|
Nous avons maintenu la liste d'envoi électronique d'information sur les produits de santé, qui compte 10 000 abonnés, soit une augmentation de 18 % par rapport à l'année précédente.
http://www.hc-sc.gc.ca/dhp-mps/medeff/subscribe-abonnement/index_f.html
L'envoi comportait le Bulletin canadien des effets indésirables, publication trimestrielle qui alerte les professionnels de la santé relativement aux effets indésirables déclarés au Canada. Le Bulletin est considéré comme une source d'information qui fait autorité et est cité dans les revues professionnelles de médecine et de santé et dans les médias, ce qui révèle un vif intérêt à l'égard de l'innocuité des médicaments.
http://www.hc-sc.gc.ca/dhp-mps/medeff/bulletin/index_f.html
Dans le cadre de nos efforts soutenus de communication des risques associés aux produits de santé, nous avons affiché 115 « avis » sur le site Internet - 60 pour les professionnels de la santé et 55 pour le public, y compris un sur les anti-inflammatoires non stéroïdiens (AINS) du sous-groupe des inhibiteurs sélectifs de la cyclo-oxygénase-2 (COX-2), ce qui représente une augmentation de 51 % comparativement à
l'année précédente.
http://www.hc-sc.gc.ca/ahc-asc/media/advisories-avis/2004/2004_69_f.html
|
|
Prendre des mesures afin de mieux protéger les aliments contre les risques liés à l'EBS ou « maladie de la vache folle » en interdisant l'entrée de certains articles à risque dans la chaîne alimentaire humaine
|
Le Ministère a dépensé approxmativement
2 millions de dollars pour les mesures de sécurité relatives à l'ESB, y compris l'évaluation et la recherche relatives aux risques que représente pour les Canadiens la consommation de boeuf et de produits du boeuf canadiens. En collaboration avec l'ACIA, nous avons mis en vigueur de nouvelles mesures de contrôle des aliments pour animaux et accru la surveillance, ce qui renforcera sensiblement les mécanismes de sécurité canadiens relatifs à l'ESB; nous serons ainsi beaucoup plus en mesure de prévenir les
crises, de protéger la santé des animaux et d'assurer la salubrité des aliments.
|
|
Accroître la capacité globale de réaction aux problèmes de santé et de sécurité publiques associés aux aliments, à la nutrition et aux produits de santé et élaborer un nouveau programme pour évaluer l'efficacité thérapeutique des produits de santé vendus sur le marché
|
Nous avons utilisé une base de données pour stocker, évaluer et extraire les déclarations d'effets indésirables de
médicaments. Des évaluations de causalité ont été effectuées sur 1 000 déclarations.
De plus, nous avons amélioré les activités d'évaluation des rapports périodiques sur l'innocuité (PSUR) pour les médicaments vétérinaires et nous avons commencé à intégrer l'utilisation de ces documents aux évaluations préalables et postérieures à la commercialisation des produits. Les rapports PSUR sont produits par les fabricants de médicaments et résument les antécédents relatifs à l'innocuité et à l'efficacité
d'un produit de santé après sa mise sur le marché, à l'échelle mondiale.
Nous avons amorcé l'élaboration de rapports trimestriels sur la nature et l'origine possible des effets indésirables déclarés.
http://www.hc-sc.gc.ca/vetdrugs-medsvet/pharmacovigilance_f.html
Nous avons élaboré et achevé l'analyse de l'accessibilité de renseignements complets sur l'efficacité et l'innocuité des produits de
santé pour les enfants, de même que sur les aliments sains et nutritifs que ceux-ci peuvent consommer. Cette analyse a jeté les bases du Bureau des initiatives pédiatriques qui sert de centre de référence pour l'application d'une approche intégrée à un certain nombre de questions touchant les enfants - alimentation et nutrition, innocuité des médicaments et des vaccins, autres produits thérapeutiques et diagnostiques.
De plus, nous avons contribué financièrement et participé à l'élaboration de
normes nationales sur la sûreté du sang et publié des lignes directrices sur les bonnes pratiques de fabrication pour les produits radiopharmaceutiques ainsi que sur la prévention des erreurs médicales par le biais de l'initiative « produits à présentation et à consonance semblables ».
Le Ministère collabore avec ses partenaires provinciaux et territoriaux, dans le cadre de la Stratégie nationale sur les produits pharmaceutiques, pour renforcer l'innocuité et l'efficacité des médicaments à usage
humain dans le monde réel.
|
|
Renforcer la communication des risques aux patients, au public et aux professionnels de la santé grâce à une coopération accrue avec les partenaires internes et externes, à de nouvelles lignes directrices pour l'industrie sur la communication avec les professionnels de la santé et le public et à la communication de renseignements aux Canadiens sur les risques pour la santé associés aux aliments et à la nutrition
|
Nous avons continué
de produire des renseignements à jour à l'intention du public et des professionnels de la santé.
http://www.hc-sc.gc.ca/dhp-mps/vet/advers-react-neg/index_f.html
|
|
Continuer d'exercer un leadership décisif pour l'exécution du volet « Salubrité des aliments » du Cadre stratégique pour l'agriculture (CSA), en mettant l'accent sur l'élaboration de politiques et de stratégies
d'intervention à l'égard des risques pour la santé publique présents dans les exploitations agricoles; collaborer avec AAC et l'ACIA afin d'examiner les programmes de salubrité alimentaire à la ferme mis en place par l'industrie agricole et aider celle-ci à contrer efficacement les risques pour la santé publique tels que les maladies d'origine alimentaire, en investissant 32,5 millions de dollars en cinq ans
|
Aux fins du Cadre stratégique pour l'agriculture, nous avons continué de
collaborer étroitement avec AAC, l'ACIA et l'Agence de santé publique du Canada afin d'élaborer, d'ici 2007-2008, des politiques et des normes pour accroître la salubrité des aliments à la ferme et aider l'industrie à prendre des mesures efficaces à l'égard des risques pour la santé publique. À cette fin, nous avons mis en oeuvre plus de 40 projets de politiques, d'établissement de normes et de recherche, dont :
-
élaboration d'une stratégie pour améliorer la salubrité des aliments crus
d'origine animale;
-
coordination stratégique à la ferme et appui à l'élaboration de politiques;
-
communication et sensibilisation au sujet des systèmes de salubrité des aliments à la ferme;
-
élaboration d'un système national intégré qui assure la salubrité des aliments grâce à une participation accrue des intervenants à l'établissement d'un cadre national de politique alimentaire;
-
examen des plans de salubrité alimentaire à la ferme élaborés par l'industrie. Nous avons
participé à un examen technique. L'industrie prépare actuellement six examens techniques. Vingt et un organismes nationaux de producteurs ont exprimé un intérêt pour la réalisation d'examens techniques par le Ministère.
De plus, nous avons exécuté cinq projets de recherche clés, notamment la mise au point de techniques moléculaires rapides pour détecter la présence de la bactérie
E. coli
dans les aliments, ainsi que l'élaboration et la validation de méthodes pour l'analyse d'une toxine
présente naturellement dans le lait.
|
|
Continuer d'établir des limites maximales de résidus (LMR) pour les résidus de médicaments vétérinaires présents dans les aliments d'origine animale
|
Nous avons établi cinq autres LMR, portant le total à 184, soit un niveau comparable à celui atteint par d'autres organismes étrangers.
http://www.hc-sc.gc.ca/dhp-mps/vet/mrl-lmr/index_f.html
|
|
Poursuivre l'Étude de la diète totale et publier les données sur le site Internet du Ministère
|
Nous avons dépensé 500 000 $ pour l'Étude de la diète totale afin de surveiller la quantité d'éléments nutritifs et de contaminants (p. ex. plomb, mercure et arsenic) et autres produits chimiques présents dans la chaîne alimentaire, étant donné que l'absorption de quantités excessives de contaminants peut avoir des effets néfastes sur la santé des consommateurs.
http://www.hc-sc.gc.ca/fn-an/surveill/total-diet/index_f.html
|
|
Travailler avec Statistique Canada et l'Institut canadien d'information sur la santé afin d'améliorer les activités de surveillance qui fournissent des renseignements fiables et à jour sur l'apport alimentaire et le bien-être nutritionnel des Canadiens
|
Grâce à un investissement de plus de
350 000 $, nous avons élaboré et mis en oeuvre conjointement le Cycle 2.2 et le volet « Nutrition » de l'Enquête sur la santé dans les collectivités canadiennes (ESCC). L'ESCC est une enquête fédérale qui vise à fournir des renseignements sur la santé aux niveaux régional et provincial. Elle est la source de données pour de nombreux indicateurs de la santé produits par Statistique Canada et par l'Institut canadien d'information sur la santé.
http://www.hc-sc.gc.ca/fn-an/surveill/nutrition/index_f.html
|
|
Établir de nouveaux centres régionaux dans le pays en vue de déclarer les effets indésirables des médicaments et intensifier les efforts visant à communiquer au public les effets indésirables des médicaments en temps opportun
|
En août 2005, deux nouveaux centres régionaux de déclaration des effets indésirables des médicaments, établis au Manitoba et en Alberta, se sont
ajoutés aux cinq centres existants. Ces centres servent de points de contact pour le Programme canadien de surveillance des effets indésirables des médicaments.
http://www.hc-sc.gc.ca/hpfb-dgpsa/tpd-dpt/arc_announcement_f.html
Nous avons terminé le travail initial sur un nouveau système de déclaration des incidents liés aux médicaments, appelé « MedEffectCanadaMedEffet ». Il s'agit d'un
portail Internet à guichet unique qui sera utilisé pour recueillir l'information sur les effets indésirables et les problèmes relatifs à l'utilisation des médicaments et pour fournir de l'information à jour au milieu des soins de santé sur l'utilisation sûre des produits.
|
|
Élaborer un nouveau programme post-approbation pour surveiller l'efficacité thérapeutique
|
Nous élaborons un nouveau programme pour évaluer l'efficacité thérapeutique des produits de santé après leur
mise sur le marché. L'un des volets du programme consiste à acheter des données sur l'efficacité par l'intermédiaire d'un contrat avec Intercontinental Medical Statistics (IMS), afin de mener des évaluations ciblées après commercialisation.
|
|
Continuer de travailler à l'établissement d'un système de déclaration des incidents associés aux médicaments
|
De concert avec la FDA des É.-U. et l'Agence européenne pour l'évaluation des médicaments, nous avons poursuivi
l'élaboration d'un système amélioré d'information sur les effets indésirables des médicaments pour le Canada, appelé Adverse Reaction Reporting Database.
Un solide programme externe est maintenu par l'intermédiaire d'un réseau national de centres régionaux de déclaration des effets indésirables dans l'ensemble du Canada. Des liens ont été établis avec tous les gouvernements afin d'assurer la coordination des déclarations et des activités connexes de diffusion des données.
|
|
Évaluer la
technologie sans fil comme outil possible pour déclarer les réactions indésirables et les incidents médicaux et pour diffuser les renseignements essentiels sur l'innocuité et l'efficacité
|
Nous avons créé un outil informatique pratique, selon les spécifications du Programme canadien de surveillance des effets indésirables des médicaments, afin de faciliter la déclaration des effets indésirables et la communication des renseignements assujettis au temps par l'intermédiaire du système canadien
de déclaration des effets indésirables des médicaments. L'outil sera mis à l'essai en 2005-2006.
http://www.hc-sc.gc.ca/dhp-mps/prodpharma/index_f.html
|
|
Examiner de nouveaux mécanismes de surveillance de la prise de médicaments pour détecter les effets indésirables graves et potentiellement mortels pour les enfants. Effectuer une étude de deux ans pour déterminer la faisabilité d'une
surveillance active visant à détecter les réactions indésirables graves et potentiellement mortelles pour les enfants de 0 à 18 ans
|
En janvier 2004, le Ministère, en collaboration avec la Société canadienne de pédiatrie et le Pharmaceutical Outcomes Programme du Children's and Women's Health Centre of British Columbia, a amorcé une étude de deux ans en vue d'examiner la possibilité d'utiliser des méthodes de surveillance active pour produire des données supplémentaires sur les médicaments ayant des
effets indésirables graves et potentiellement mortels pour les enfants de moins de 18 ans. Cette étude, la première du genre au Canada, aidera à renseigner le nouveau Bureau des initiatives pédiatriques. Elle pourrait également éclairer l'établissement d'un réseau de personnes affectées à la surveillance dans les hôpitaux pour enfants du pays.
http://www.cps.ca/francais/PCSP/Etudes/medicaments.htm
|
|
Effectuer une étude de faisabilité et mettre en place un programme informatique pour détecter les similarités de présentation et de consonance, avec possibilité de partager le programme avec la
U.S. Food and Drug Administration
|
Le Ministère continue de surveiller les noms de produits de santé à consonance et à présentation semblables. Les similarités de présentation et de consonance peuvent entraîner un risque pour la santé en prêtant à des erreurs médicales lors de la
prescription, de la distribution ou de l'administration des produits.
Des lignes directrices pré-commercialisation et post-commercialisation ont été publiées; toutefois, nous n'avons pas pu respecter le calendrier prévu pour l'achat et la mise en place d'un programme informatique permettant de détecter les noms des médicaments à présentation et à consonance semblables, car des préoccupations liées à la protection des renseignements personnels ont retardé indéfiniment la signature de l'accord entre
le Canada et les États-Unis.
http://www.hc-sc.gc.ca/dhp-mps/brgtherap/activit/fs-fi/lasa-pspcs_factsheet-faitsaillant_f.html
|
|
Continuer d'accroître la conformité de l'industrie à la réglementation au moyen d'inspections post-commercialisation. Mettre en oeuvre le Programme d'inspection des établissements pour les matériels médicaux et intensifier les
inspections de conformité pour la déclaration des effets indésirables des médicaments
|
Nous avons effectué 24 inspections, sur les 50 prévues, pour déterminer si les fabricants se conformaient aux exigences concernant la déclaration des effets indésirables des médicaments et mentionnaient les cas d'inefficacité inhabituelle dans les présentations de drogues nouvelles. Les résultats ont révélé que les établissements sont presque entièrement conformes au règlement. Après la publication
du rapport de la vérificatrice générale sur les matériels médicaux en 2004, au cours de la première année de mise en oeuvre du Programme d'inspection des établissements pour les matériels médicaux, soit 2004-2005, plus de 45 inspections ont été menées (objectif de 70). Ces inspections ont permis de cerner un certain nombre de secteurs où les établissements pourraient apporter des améliorations pour être entièrement conformes au règlement. Notre incapacité d'atteindre les objectifs est principalement
attribuable à la complexité croissante de l'exécution d'inspections dans le cadre de nouveaux programmes de ce genre et au fait que les fabricants doivent comprendre ce qu'on attend d'eux. Avec le temps, nous appliquerons ces leçons pour améliorer les prévisions, comme on le fait pour d'autres programmes établis.
http://www.oag-bvg.gc.ca/domino/rapports.nsf/html/20040302cf.html
|
|
Mettre en oeuvre un programme d'inspection de la conformité des établissements dans le cadre de l'Examen national sur les cellules, les tissus et les organes
|
Après notification des provinces, des inspections de conformité aux fins de l'Examen national sur les cellules, les tissus et les organes ont commencé en mars 2005 - cinq sur 120 ont été achevées.
|
Priorité 4 : En cours
Améliorer la transparence, l'ouverture et la responsabilisation afin de
renforcer la confiance du public et les relations avec les intervenants
Les Canadiens s'attendent à obtenir des renseignements appropriés, à ce que leurs points de vue soient entendus et à ce que les gouvernements soient tenus responsables de la manière dont ils utilisent l'expertise et l'avis du public. Quatre-vingt pour cent (80 p. 100) des Canadiens auraient une perception plus positive du processus décisionnel gouvernemental s'ils savaient que le public y contribue.
[16]
Ceci est particulièrement vrai lorsque les mesures et les décisions prises par les gouvernements ont des conséquences réelles sur la vie des Canadiens et sur leur capacité de gérer leur santé. Santé Canada reconnaît l'importance fondamentale de la participation du public et la nécessité de renforcer la capacité du gouvernement d'appuyer cette participation. En réaction à ces défis, nous avons élaboré et mis en oeuvre de nombreuses initiatives en vue d'accroître l'engagement du public et de l'amener à
mieux comprendre le processus décisionnel et à y participer davantage - y compris la façon de tenir compte des risques et des avantages et de la complexité des enjeux - et de renforcer la confiance du public et les relations avec les intervenants.
16. Rapport à Santé Canada : enquête sur le rendement annuel de 2005, The Strategic Counsel, mars 2005
|
Engagements
définis dans le RPP de 2004-2005
|
Rapport sur les résultats
|
|
Améliorer la transparence, l'ouverture, la responsabilité commune et la responsabilisation
|
Le Ministère a continué d'examiner les priorités législatives dans le secteur de la protection de la santé, afin d'améliorer la transparence, l'ouverture et la responsabilisation.
Nous avons élaboré une politique sur la déclaration volontaire de renseignements dans le cadre d'activités de
participation du public, afin de promouvoir la sensibilisation et la compréhension auprès des participants, dans le cadre d'activités de consultation. La politique fera l'objet d'un projet pilote et sera évaluée sur les plans du processus et des résultats avant sa mise en oeuvre systématique.
http://www.hc-sc.gc.ca/ahc-asc/pubs/cons-pub/vsi_pvi_intro_f.html
De plus, nous avons élaboré des fiches de
renseignements afin d'informer plus efficacement les publics externes sur nos activités. Nous voulons ainsi permettre une meilleure compréhension du rôle et de l'approche de Santé Canada lorsqu'il s'agit de réduire les risques pour la santé et d'optimiser l'innocuité des produits de santé et la salubrité des aliments.
http://www.hc-sc.gc.ca/ahc-asc/branch-dirgen/hpfb-dgpsa/3kit-fiche/index_f.html
Nous nous apprêtons à établir un Bureau de l'ombudsman du public, qui entendra les préoccupations et réglera les plaintes du public et de l'industrie au sujet de l'administration de la
Loi sur les aliments et drogues.
http://www.hc-sc.gc.ca/ahc-asc/media/nr-cp/2005/2005_24_f.html
En 2004-2005, nous avons établi le Bureau des initiatives pédiatriques afin de coordonner les questions de
sécurité touchant les enfants et nous avons fourni une base de données sur les médicaments accessibles au public.
En février 2005, le Ministère a annoncé qu'il solliciterait le point de vue des patients, des médecins, des intervenants et du public au sujet des risques et des avantages des AINS inhibiteurs sélectifs de la COX-2. Nous avons également annoncé notre intention d'établir un conseil de sécurité permanent pour nous conseiller sur ces questions de manière continue.
http://www.hc-sc.gc.ca/ahc-asc/media/nr-cp/2005/2005_stmt-dec_cox2_f.html
En 2004-2005, nous avons entrepris 163 activités de mobilisation du public, à un coût estimatif de 703 000 $, principalement par le biais d'envois postaux et d'affichages sur Internet, en vue d'obtenir une rétroaction. La consultation portait sur les sujets suivants :
-
processus d'élaboration de
politiques : 24 activités;
-
processus de réglementation : 21 activités;
-
autres questions dont des mesures liées à la transparence, aux bonnes pratiques de fabrication, au renforcement de la capacité des intervenants.
La consultation concernant l'Initiative sur l'impact environnemental est un bon exemple de ce type d'activité. Ces activités ont été menées en application de la
Loi canadienne sur la protection de l'environnement
1999, selon laquelle toutes les nouvelles
substances doivent faire l'objet d'une évaluation relativement à leur incidence sur la santé humaine et sur l'environnement. En outre, les Canadiens ont été tenus au courant de nos progrès en ce qui concerne le sang et les composants du sang, de même que les cellules, les tissus et les organes.
http://www.hc-sc.gc.ca/dhp-mps/brgtherap/reg-init/cell/cto_presentation_2_f.html
Notre ministère a
continué de respecter son délai d'exécution d'un jour pour la réponse aux demandes de renseignements par l'intermédiaire d'un compte de courriel générique. L'un des principaux objectifs consiste à sensibiliser et à informer les citoyens et les clients au sujet des diverses ressources offertes sur les sites Internet de Santé Canada. En 2004, nous avons répondu à environ 2 580 demandes, comparativement à 1 773 demandes en 2003. Près de la moitié des demandes (48 %) provenaient du public
canadien, 38 %, de l'industrie et le reste, du milieu universitaire (6 %), des professionnels de la santé (4 %), des gouvernements fédéral, provinciaux et territoriaux (3 %) et des gouvernements étrangers (1 %).
Nous avons rédigé et diffusé une fiche d'information traitant de l'« élimination sûre des produits pharmaceutiques ». De concert avec Environnement Canada, nous avons affecté 230 000 $ à une recherche conjointe sur les effets que peuvent avoir sur
l'environnement, particulièrement sur l'eau, les substances présentes dans les produits visés par la
Loi sur les aliments et drogues
, comme les produits pharmaceutiques et de soins personnels. Les projets ont été financés par le Fonds d'intégrité de la
Loi canadienne sur la protection de l'environnement
, qui fournit annuellement près de 2 millions de dollars pour appuyer les activités orientées vers l'élaboration d'un règlement approprié sur l'évaluation environnementale des substances
présentes dans les produits visés par la
Loi sur les aliments et drogues
, de même que certaines évaluations. Une collaboration au sein de Santé Canada a également entraîné l'approbation d'un document intitulé Document sur l'analyse des options : Régime d'évaluation environnementale des substances nouvelles présentes dans les produits visés par la
Loi sur les aliments et drogues.
Ce document sera distribué aux intervenants au printemps 2005.
http://www.hc-sc.gc.ca/ewh-semt/contaminants/person/impact/index_f.html
En 2004-2005, nous avons élaboré un modèle logique complet en matière de biotechnologie, de même que des indicateurs de rendement et un formulaire de collecte de données. De plus, nous avons effectué des recherches en vue d'améliorer qualitativement et quantitativement l'information biotechnologique accessible au public par voie électronique.
L'insuffisance des ressources humaines et la lenteur du processus d'approbation du nouveau matériel Web ont continué de poser des défis.
De plus, nous avons renforcé nos capacités de vérification et d'évaluation afin de répondre aux attentes en matière de reddition de comptes et d'intendance énoncée dans le Cadre de responsabilisation de gestion du gouvernement. Les résultats des activités de vérification et d'évaluation sont désormais reliés plus étroitement à l'élaboration de politiques et de programmes, à la
planification, ainsi qu'à la mesure et à la gestion du rendement.
Dans le cadre de notre évaluation des activités de l'ACIA concernant la salubrité des aliments, nous avons mis au point un cadre d'évaluation pour le Programme de modernisation de l'inspection de la volaille de l'ACIA. Le rapport sur le Programme de gestion de la qualité du poisson a été établi dans les délais prévus -mai 2004 - et publié en juin 2005.
|
|
Élaborer et commencer à mettre en oeuvre une Stratégie de
participation du public qui optimisera la compréhension du processus décisionnel par le public et la participation du public à ce processus, renforcera les relations entre le Ministère et les intervenants et favorisera des activités de mobilisation du public plus efficaces et plus efficientes
|
Nous avons élaboré un Cadre de participation du public (CPP) pour faire en sorte que nos activités de mobilisation du public soient uniformes, valables et efficaces. Le Cadre s'appuie sur les résultats
d'ateliers tenus dans 11 villes de septembre à novembre 2004, qui ont réuni 134 participants. Le CPP maintient un juste équilibre entre les obligations liées à la participation du public et les responsabilités réglementaires, tout en assurant un apport de la part des divers intervenants afin de permettre des décisions éclairées.
http://www.hc-sc.gc.ca/ahc-asc/pubs/cons-pub/piframework-cadrepp_f.html
|
|
Rendre le processus de réglementation des produits thérapeutiques et des aliments plus accessible aux intervenants, y compris aux groupes de patients et de consommateurs
|
Afin d'accroître l'accessibilité, le Ministère a tenu un forum pour permettre au public, notamment aux patients, aux consommateurs et aux représentants des médias, d'entendre des exposés présentés par l'industrie, des experts influents et nos représentants dans le cadre des réunions
régulières d'un comité consultatif d'experts. De plus, notre comité consultatif sur la gestion compte désormais des représentants des patients et des consommateurs.
Nous avons également collaboré avec des organisations de patients et de consommateurs afin d'offrir à ces groupes une première séance d'information sur les sujets clés retenus au terme d'une évaluation officielle des besoins.
http://www.hc-sc.gc.ca/ahc-asc/pubs/hpfb-dgpsa/info-prog_f.html
|
|
Mettre à jour les normes et les cadres de réglementation sur le sang et les composants sanguins, ainsi que sur les cellules, les tissus et les organes
|
Le Ministère a mis à jour les normes nationales touchant le sang, de même que les cellules, les tissus et les organes. Ces normes ont été publiées par l'Association canadienne de normalisation à la demande des intervenants et de la Commission Krever sur les normes
nationales. La mise à jour portait sur l'information de sécurité et les nouvelles technologies concernant la transfusion et la transplantation. Nous avons élaboré un plan de discussion en vue de nos consultations auprès des intervenants. Ce plan résumait les options offertes pour faciliter la déclaration des événements indésirables, la conformité et l'exécution et pour favoriser une participation éclairée à la détermination des options à retenir. De plus, nous avons réalisé des progrès importants dans
l'élaboration du cadre de réglementation relatif aux cellules, aux tissus et aux organes et nous les avons communiqués aux intervenants. Il y a eu toutefois des retards dans les travaux, pour tous les éléments essentiels du cadre, en raison de la complexité de la rédaction du règlement.
Les normes de l'Association canadienne de normalisation sur la sûreté du sang ont été adoptées comme normes nationales pour le sang et les composants du sang.
Nous avons réalisé des progrès substantiels dans la
rédaction d'un cadre de réglementation révisé pour le sang et les composants du sang; nous avons également publié une directive destinée aux établissements relativement à la prévention de la transmission du virus du Nil occidental et du SRAS par le biais de la transplantation.
http://www.hc-sc.gc.ca/dhp-mps/brgtherap/reg-init/blood-sang/blood_qa_sang_qr_f.html
http://www.hc-sc.gc.ca/dhp-mps/brgtherap/reg-init/cell/cto_let_stakeholders-intervenants_f.html
http://www.hc-sc.gc.ca/dhp-mps/brgtherap/activit/forums/wnv-vno/2004/wnv-vno_2004_cto_gui-dir_f.html
http://www.hc-sc.gc.ca/dhp-mps/brgtherap/activit/forums/wnv-vno/2004/wnv-vno_2004_min-pv_06-15_cto_telecon_f.html
|
|
Évaluer des stratégies afin de permettre au public de fournir des commentaires lors de l'examen des présentations des aliments nouveaux
|
Nous avons mené un projet pilote, de concert avec l'ACIA et CropLife Canada, association industrielle représentant les concepteurs de végétaux
issus de la biotechnologie. Le projet consiste à afficher sur Internet, à la réception d'une nouvelle présentation, un « avis » qui décrit le produit et résume les renseignements scientifiques fournis aux fins d'examen réglementaire. Pour la première fois, le public a 60 jours pour présenter des commentaires sur des questions scientifiques pertinentes pour l'évaluation de chaque produit nouveau. Nous continuons de renforcer les relations et la confiance dans le public et chez les intervenants.
|
|
Solliciter les commentaires des partenaires et des intervenants afin de mettre à jour des politiques et des directives comme le
Guide alimentaire canadien pour manger sainement
, au moyen d'un processus conçu pour engager les Canadiens à mieux comprendre l'importance d'une alimentation saine et leur part de responsabilité dans le maintien et l'amélioration de leur santé et de leur bien-être nutritionnels
|
En février 2005, nous avons tenu un forum d'intervenants
afin d'échanger l'information et d'amorcer un premier dialogue sur les initiatives clés. Les discussions ont porté sur les conséquences de l'Initiative de réglementation intelligente et du Renouveau législatif de Santé Canada pour la politique relative à la salubrité des aliments et à la qualité nutritionnelle.
Nous avons consulté un large éventail d'intervenants relativement à la révision du
Guide alimentaire canadien pour manger sainement.
Ces consultations englobaient les consommateurs,
les universitaires, l'industrie, des organismes non gouvernementaux et les autres administrations. Deux comités ont été établis pour fournir des avis et des conseils pour la révision du Guide alimentaire - un groupe de travail interministériel et le Comité consultatif sur le Guide alimentaire, qui réunit des experts des secteurs de la santé publique, de la politique de santé, de l'éducation nutritionnelle, de la prévention des maladies, de l'industrie et de la communication.
http://www.hc-sc.gc.ca/fn-an/food-guide-aliment/revision/index_f.html
|
|
Établir des objectifs de rendement clairs et internationalement comparables, pour toutes les étapes du processus d'examen de la réglementation des produits thérapeutiques et réviser les méthodes de mesure du rendement afin d'assurer l'harmonisation avec les autres organismes de réglementation influents
|
Le Ministère a
participé à une étude comparative internationale du Centre for Medicines Research sur les objectifs de rendement pour l'examen des présentations de drogues nouvelles. L'étude a révélé que les objectifs du Canada étaient comparables à ceux des autres pays. Elle a également révélé qu'il était difficile de comparer les normes de rendement relatives à l'examen car les processus réglementaires, les types de présentation et les normes de service ne sont pas identiques d'un organisme de réglementation à l'autre. Afin de
mieux comprendre les différences et les similarités, nous avons amorcé l'élaboration d'une méthode permettant de comparer les structures tarifaires, les normes de rendement et les processus de réglementation de différentes administrations, tout en respectant les exigences de la
Loi sur les frais d'utilisation
.
|
|
Améliorer la reddition de comptes au public en produisant des plans et des rapports de rendement annuels plus utiles et plus compréhensibles pour les activités
liées aux produits de santé, aux aliments et à la nutrition
|
Nous avons publié le premier Rapport sur les priorités et les réalisations de la Direction des aliments. Ce rapport énonce les priorités stratégiques de la Direction, décrit ses domaines d'activité en 2003-2004 pour certaines priorités, présente les principales activités et réalisations et souligne certains défis et nouvelles priorités liés à la vision de la Direction - « être l'autorité la plus fiable en matière d'innocuité et de
valeur nutritive des aliments, chargée d'établir des politiques et des normes, de fournir des avis et des renseignements ».
http://www.hc-sc.gc.ca/ahc-asc/pubs/hpfb-dgpsa/fd-da/rpt_priorities_achievements-priorites_realisations_dec_2003_01_f.html
Le Ministère a également publié le deuxième rapport d'étape sur la SAPT.
http://www.hc-sc.gc.ca/ahc-asc/branch-dirgen/hpfb-dgpsa/index_f.html
Nous avons élaboré un nouveau rapport de rendement sur l'examen réglementaire des produits pharmaceutiques et biologiques et des instruments médicaux afin de rationaliser et d'améliorer ce type de rapport. Le rapport décrit également l'influence exercée par d'autres intervenants clés sur l'accès aux nouveaux médicaments au Canada (p. ex. le
Conseil d'examen du prix des médicaments brevetés).
|
|
